原子轨道与轨道杂化理论
轨道杂化理论有两部分,一是轨道,二是杂化,理解杂化之前,先理解轨道,理解了轨道,杂化就好理解了。
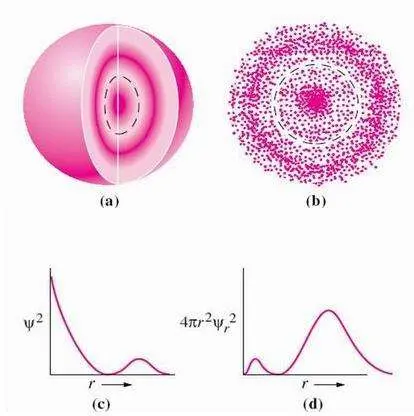
轨道指的是围绕着原子运动的电子运行的轨道,更准确地说是电子出现在外空间某个地方的概率,有s、p、d、f、g、h等,再往后的轨道属于我未知的领域。
- 每个轨道上,最多能够容纳两个电子,运动方向相反(修正,此处应该为“相同”,感谢评论区指出)。轨道上有一个电子的时候不稳定,有两个电子的时候稳定。大概是拨浪鼓的样子。
- s轨道有1个,p轨道有3个,d轨道有5个,f轨道有7个,g轨道有9个,h轨道有11个,以此类推。
- 在原子核外面的电子是分层的,每层可容纳的电子数最多是2n²,就是第一层最多2个,第二层最多8个,第三层最多18个。原子外面的电子并不是像下图那样绕着一个球运动,而是按照轨道的方式运动。
- 补注:为什么容纳电子数是2n²呢?因为:
- 第1层外层只有1个s轨道,轨道总数量为1=1²,最大可容纳电子数为2*1²=2;
- 第2层外层有1个s轨道和3个p轨道,可容纳的轨道数为1+3=4=2²,最大可容纳电子数为2*2²=8;
- 第3层外层有1个s轨道、3个p轨道和5个d轨道,可容纳的轨道数为1+3+5=9=3²,最大可容纳电子数为2*3²=18;
- 可推导第n层电子层,可容纳的最多轨道数为n²,可容纳的最多电子数为2n²
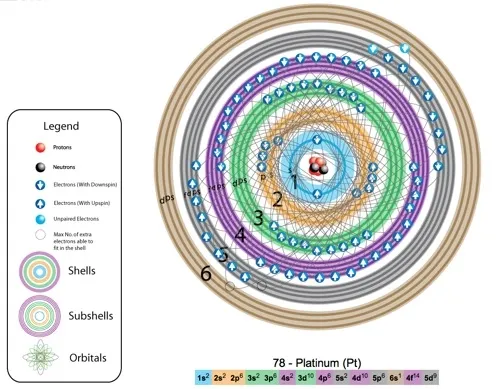
铂元素的电子层简图
- 每一层电子,都先有s轨道,再有p轨道,再有d轨道,就是说第一层的两个电子形成了一个稳定的s轨道,第二层又从s轨道开始,电子填满了才会有p轨道。
- 轨道杂化,只发生在最外层的轨道!里面已经填满了的轨道是稳定的不用管的。
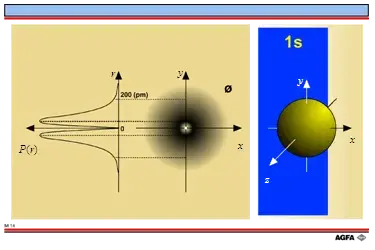
- 第一层的电子最多有两颗,是s轨道,对应的分别是氢和氦。
氢是1s1,原子外面有一个电子在s轨道上,不稳定,需要形成氢气或者和其他元素反应成为稳定的物质。
氦是1s2,原子外面有两个电子在s轨道上,稳定。
1s轨道如下:
- 第二层电子有最多八颗,第二层电子在第一层的s轨道外面,先由两颗电子形成一个第二层的s轨道,满了之后再形成p轨道。
锂是2s1,原子外面先有一个层的s轨道,第一层s轨道外面再套一个s轨道,上面只有一个电子,不稳定。
铍是2s2,原子外面先有一个层的s轨道,第一层s轨道外面再套一个s轨道,上面有两个电子,稳定。
2s轨道如下,圆环套圆环:
- 第二层的s轨道排满了之后,后面的六颗电子就按照p轨道运动
p轨道有三个,分别在xyz轴上
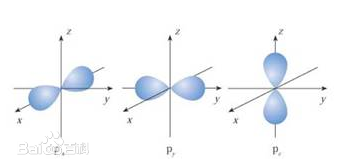
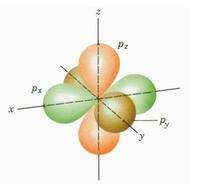
完整的三个p轨道合在一起是这样子的,对应的元素是氖(第一层一个s轨道,第二层一个s轨道,三个p轨道)。
- 以此类推,各个元素具体的轨道可以看元素周期表。
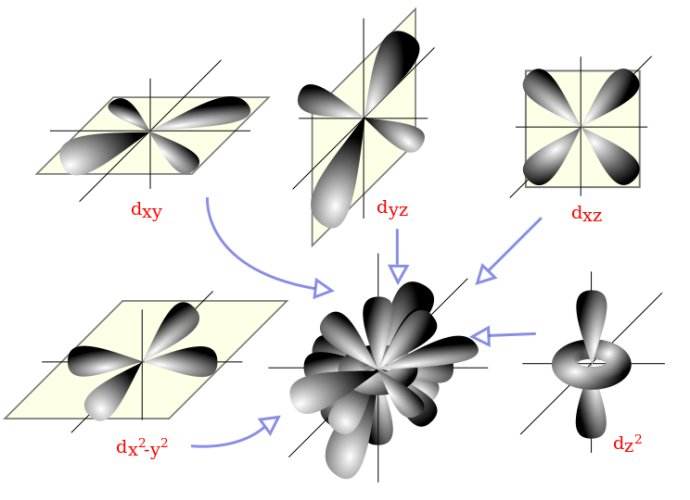
- 再接下来是属于课余知识的d轨道,长这样
- f轨道,长这样,鬼知道它们合在一起之后会乱成什么样子
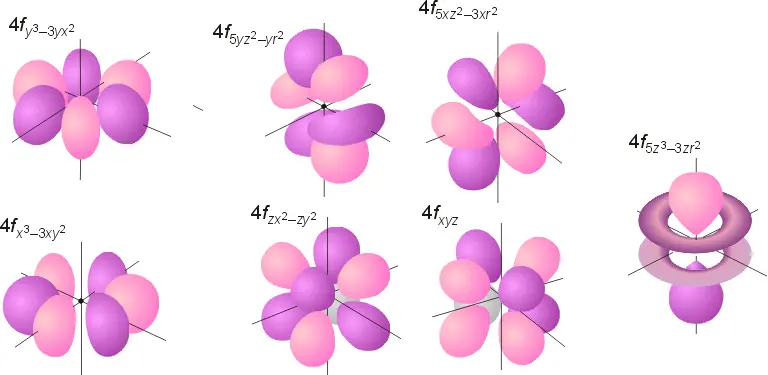
- g轨道,长这样,分别是5g、6g、7g的轨道
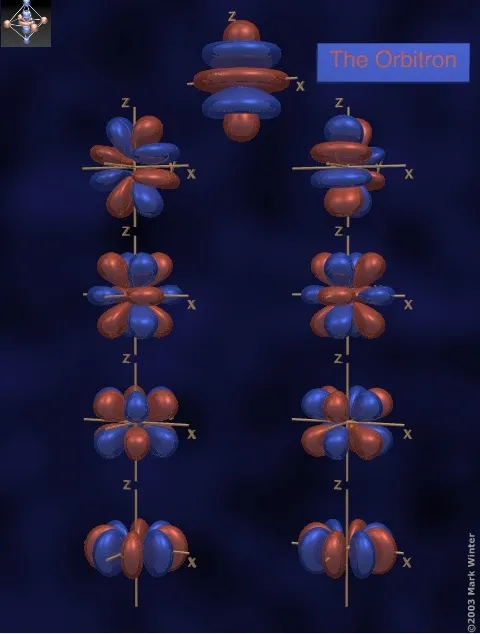
5g轨道
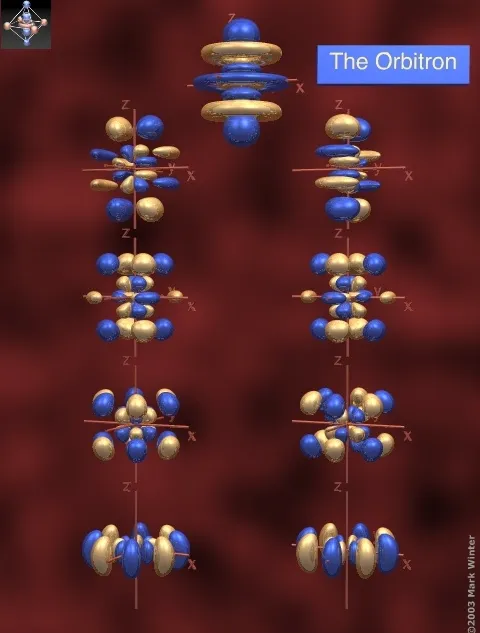
6g轨道
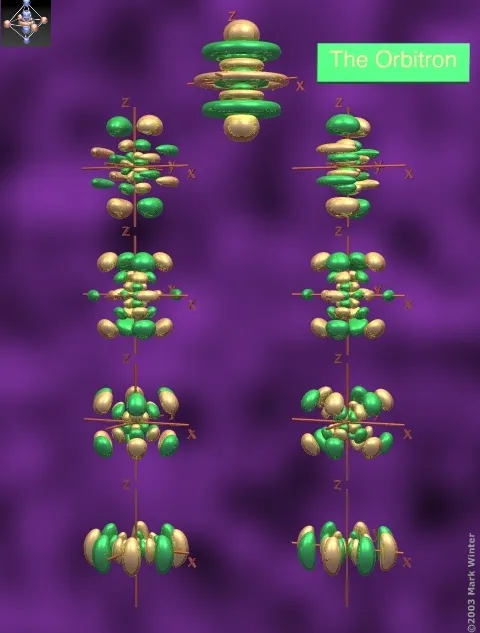
7g轨道
- 杂化,就是原子受到外部因素影响(如碳和氢、氧和氢反应),外层的不同轨道(s、p轨道)互相影响,从不稳定的应激状态变成稳定状态,重新组合成新的轨道的过程。sp杂化轨道学得最多用得最多,也被讨论得最多。有没有其他轨道之间的杂化?我估计是有的,我估计也是很复杂的。
- 什么元素容易发生杂化?有s轨道又有p轨道的,但是又不完整容易吸引外部氢元素的,所以碳氮氧都容易发生sp杂化。(氟会不会杂化我暂时不太确定,等其他高人解答吧)
- sp杂化,就是球形的s轨道和哑铃型的p轨道合体变成一大一小的新的轨道。下图是一个s轨道和一个p轨道得到两个sp1杂化轨道,右边的图中相对的一大一小两半是一个轨道。
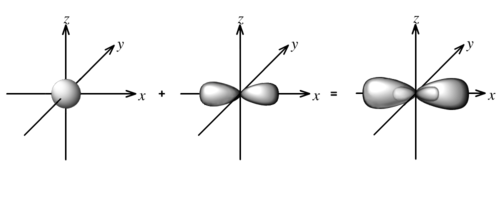
- 碳的外层电子轨道是2s2 2p2,一个s轨道,一个p轨道,两个空的p轨道,可以发生sp1、sp2、sp3、杂化
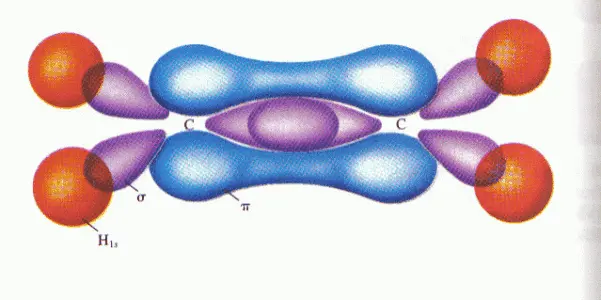
sp1杂化,最常见的是乙炔,一个碳原子sp1杂化是一个s轨道和一个p轨道杂化,得到两个成180°的sp1轨道,另外两个p轨道不杂化。注意,这里的四个轨道上分别都只有一颗电子,也就是说都不稳定。
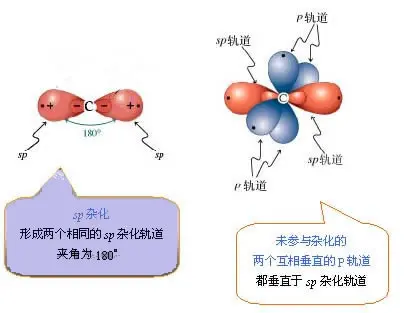
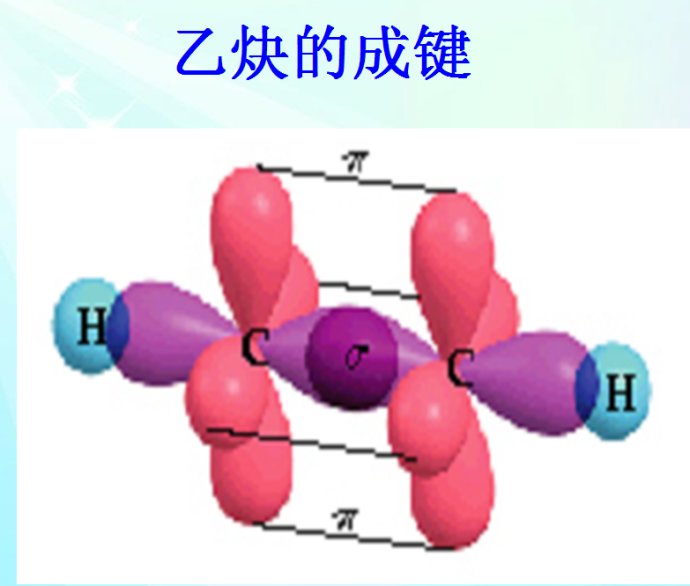
怎样才能稳定呢?两个sp1杂化的碳原子合体,再加两个氢原子,形成乙炔C2H2。其中:
- “碳原子中的一个sp1杂化轨道的一个电子”和“另一个碳原子中的一个sp1杂化轨道上的一个电子”形成一对稳定的电子;
- “碳原子另外的sp1杂化轨道的电子”和“氢原子的电子”形成一对稳定的电子;
- “碳原子两个p轨道上的电子”分别和“另一个原子中的两个p轨道上的电子”形成两对稳定的电子;同时,这两对p轨道还进一步形成两个π-π共轭。
sp2杂化,最常见的是乙烯,一个碳原子sp2杂化是一个s轨道和两个p轨道杂化,得到三个sp2杂化轨道,一个p轨道不杂化。三个sp2杂化轨道在一个平面上,成120℃夹角。
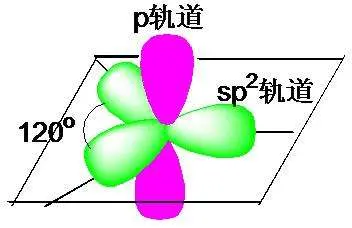
同样,这里的每个轨道上也只有一颗电子,也是不稳定的,需要两个碳原子和四个氢原子组成C2H4才稳定。p轨道也同样会形成共轭。
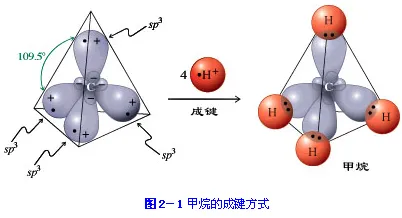
sp3杂化,最常见的是甲烷,一个碳原子sp3杂化是一个s轨道和三个p轨道杂化,得到四个sp3杂化轨道。四个sp3杂化轨道在一个正四面体的四个方向上。
- 氮的外层电子轨道是2s2 2p3,一个s轨道,一个p轨道,一个不完整的p轨道,一个空的p轨道;氧的外层电子轨道是2s2 2p4,一个s轨道,两个p轨道,一个空的p轨道。它们具体怎么杂化我也不太清楚,可以在课后问问化学老师。
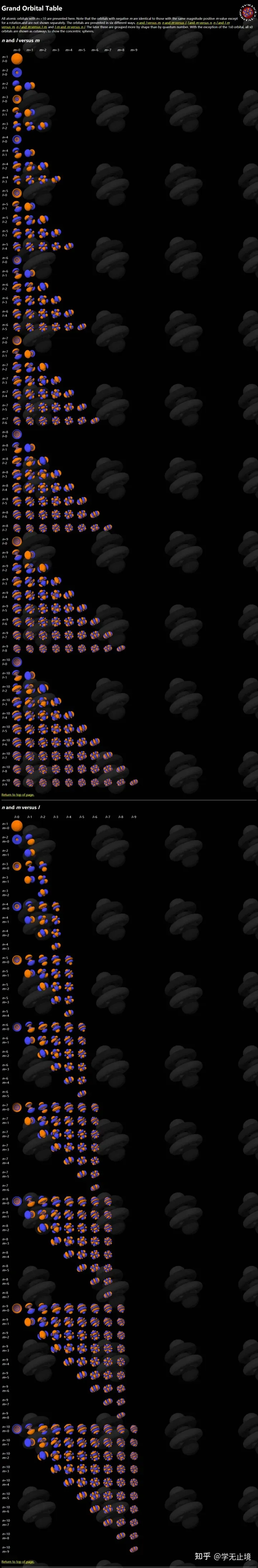
- 最后放个大Grand Orbital Table